电话举报:0591-38265150
邮件举报:cosunterjb@163.com
信件举报:福建省福州高新区乌龙江中大道7号创新园二期16号楼,邮政编码:350003,收件人:监察负责人
丙型肝炎直接抗病毒药物(DAA)治疗失败后如何治疗是当下一个比较具有挑战性的问题。近日,由美国、德国、以色列等国学者共同完成的多中心研究获得了阳性结果。研究表明,在既往含NS5A抑制剂方案治疗失败的HCV感染者中,grazoprevir、ruzasvir和uprifosbuvir联合或不联合利巴韦林的16周或24周方案安全且高效。
C-SURGE(PN-3682-021)和C-CREST Part C(PN-3682-011和-012)研究是开放标签的多中心研究,旨在评估grazoprevir、ruzasvir和uprifosbuvir联合或不联合利巴韦林治疗在含NS5A抑制剂方案治疗失败患者中的安全性和有效性。
研究纳入既往接受含NS5A抑制剂全口服方案治疗失败的患者,给予grazoprevir 100mg、ruzasvir 60mg和uprifosbuvir 450mg单药治疗24周或者联合利巴韦林治疗16周,主要有效性终点为治疗结束后12周时检测不到HCV RNA(<15 IU/mL)。
结果显示,在C-SURGE研究中,基因1型HCV感染者接受24周无利巴韦林方案治疗获得了100%(49/49)的SVR12率,接受12周联合利巴韦林方案治疗获得了98%(43/44)的SVR12率(1例失随访)(表1)。C-CREST Part C中,16周联合利巴韦林方案治疗的SVR12率为96%(23/24),其中基因1型HCV感染者为100%(2/2)、基因2型HCV感染者为93%(13/14)、基因3型HCV感染者为100%(8/8)。
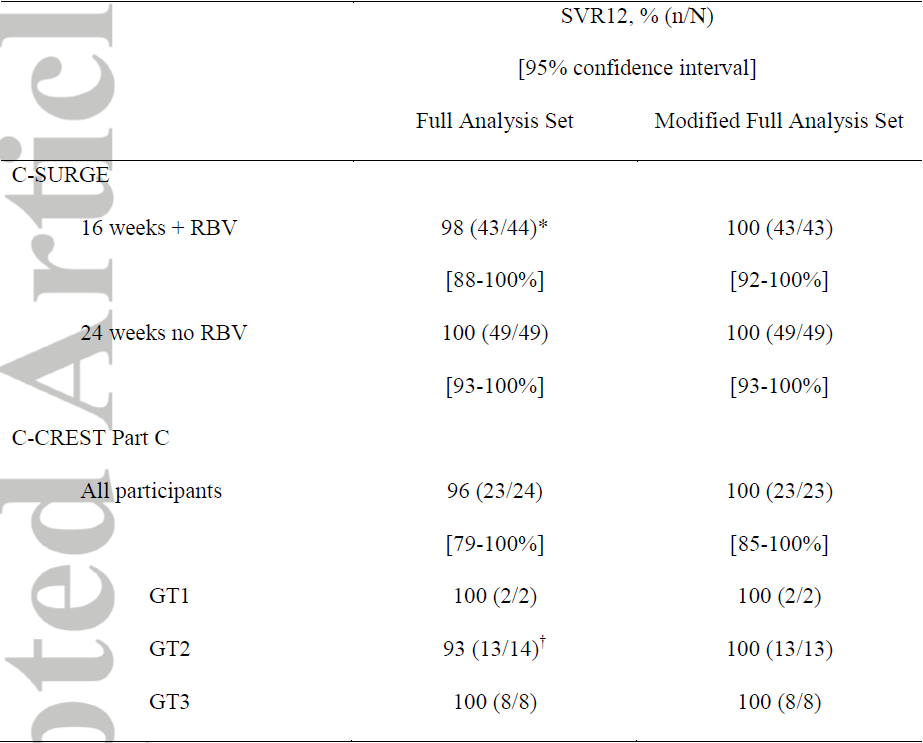
表1 持续病毒学应答(SVR)率
1例基因2型HCV感染者由于出现严重不良事件(呕吐和心动过速),在单剂量grazoprevir、ruzasvir和uprifosbuvir联合利巴韦林治疗后中断了治疗(表2)。存在基线耐药相关变异并不影响SVR12,所有完成治疗的患者中,没有患者在研究期间出现病毒学失败。

表2 安全性和不良事件