广生堂在研乙肝新药GST-HG141奈瑞可韦 Ⅰb期临床试验结果成功发表于国际权威病毒学杂志《Virology Journal》
近日,福建广生堂药业股份有限公司(简称“广生堂药业”)创新药控股子公司福建广生中霖生物科技有限公司的乙肝治疗创新药GST-HG141(英文通用名 “Neracorvir”,中文通用名 “奈瑞可韦”)的Ⅰb期临床试验结果已经成功发表。
GST-HG141奈瑞可韦是新型乙肝核心蛋白或核衣壳调节剂,属于全新机制的在研抗乙肝病毒一类新药。它通过独特的机制,有效调节乙肝病毒核心蛋白的构象,进而影响病毒的复制过程,为乙肝的临床治愈提供了新的解决方案。2024年11月,GST-HG141奈瑞可韦的临床研究成果被国际权威专业机构—美国肝病研究协会(AASLD)作为最新突破摘要(Late-breaking Abstract)形式在AASLD年会上进行展示;2024年12月,GST-HG141奈瑞可韦被国家药品监督管理局药品审评中心纳入突破性治疗品种名单,未来有望成为全球乙肝抗病毒治疗里程碑式的创新药。
该药物Ⅰ期临床试验在吉林大学第一医院(以下简称:吉大一院)一期药物临床试验病房开展,由牛俊奇教授和丁艳华教授主持完成并作为共同通讯作者将研究结果发表在《Virology Journal》杂志,2024年12月20日正式线上公开,文章表题为《Safety, pharmacokinetics, and antiviral effficacy of the novel capsid assembly modulator GST-HG141 in patients with chronic hepatitis B: a phase 1 trial with a randomized,placebo-controlled design》。
该研究为多中心、随机、双盲、安慰剂对照的多剂量、多次给药的耐受性、药代动力学和药效学的Ⅰb期临床试验研究,旨在评价GST-HG141片在慢性乙型肝炎患者中多次给药的耐受性、初步药效学和药代动力学特征。
研究共纳入30例慢性乙型肝炎(CHB)初治患者作为受试者,共设置3个GST-HG141剂量组,分别为25 mg BID(第一组)、50 mg BID(第二组)、100 mg BID(第三组)剂量组,每组各纳入10例受试者:8例接受试验药物,2例接受安慰剂。各剂量组连续给药28天,第1天-第27天每天给药2次,给药间隔12小时,第28天早上给药一次,餐后给药。
研究结果显示GST-HG141 在所有剂量下均表现出良好的安全性和耐受性
在28天用药期间没有受试者出现因药物不良反应 (ADR) 导致的死亡、严重不良事件或停药的情况,未发生肌酸磷酸激酶增高的不良反应。各剂量组不良反应发生率无明显差异,且与安慰剂组无统计学差异。未见与剂量相关性不良反应,所有不良事件均为轻度,发生率和严重程度并未随剂量增加而升高、加重。常见不良事件包括中性粒细胞计数减少(12.5%)、白细胞计数减少(8.3%)、低磷血症(8.3%)、丙氨酸氨基转移酶水平升高(8.3%)和天门冬氨酸氨基转移酶水平升高(8.3%)。
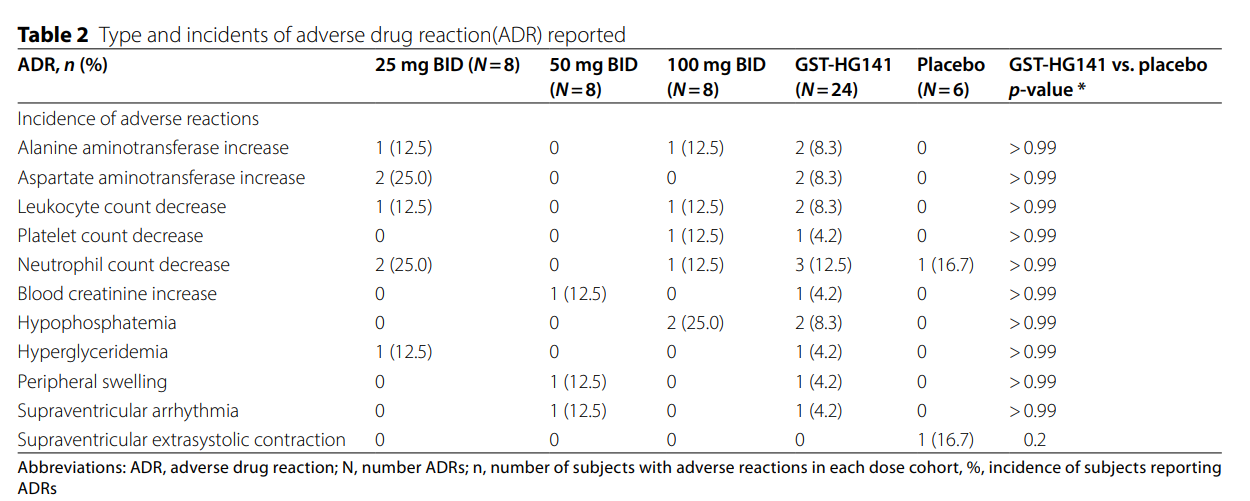
研究认为,在慢性乙型肝炎患者中, GST-HG141的剂量即使高达100mg, 其安全性仍可靠,无明显的严重安全性问题。大多数不良事件为轻度至中度(1 级或 2 级),且发生频率或严重程度都没有明显的剂量相关趋势。未发现转氨酶水平升高有关的严重不良反应。
GST-HG141具有很强的抗病毒活性,CHB患者治疗28天可大幅降低HBV DNA 和 HBV pgRNA 的水平
在治疗期间,25mg BID组、50mg BID组、100mg BID 3个剂量组受试者的HBV DNA 水平均持续降低,在第 29 天达到最低水平,与基线相比的降低幅度分别为 -3.01 (0.47) log10 IU/mL、-2.92 (1.26) log10 IU/mL、-3.43 (0.55)log10 IU/mL,25mg BID组、50mg BID组HBV DNA下降程度无明显差异,100mg BID组HBV DNA下降程度略优于前2个剂量组。停药后5天出现不同程度的反弹,但随着治疗剂量升高,反弹速度降低。
3个剂量组受试者的HBV pgRNA均较基线降低,降低幅度明显优于安慰剂组,在第29天时,25mg BID组、50mg BID组、100mg BID组与基线相比HBV pgRNA的降低幅度分别为-1.71 (1.003) log10 IU/mL、-1.93 (0.899) log10 IU/mL、-2.37 (0.784) log10 IU/mL,降低幅度具有一定剂量相关性。
各剂量组HBeAg均较基线下降,下降程度明显优于安慰剂组,25mg BID组、50mg BID组、100mg BID组与基线相比HBeAg的降低幅度分别为-0.08 (0.119) log10 U/mL、-0.05 (0.063) log10 U/mL、-0.09 (0.099) log10 U/mL,各剂量组下降程度无明显差异。各剂量组HBcrAg较基线均下降,下降程度明显优于安慰剂组,在第29天时,25mg BID组、50mg BID组、100mg BID组HBcrAg较基线平均值(标准差)降幅分别为-0.25 log10 IU/mL、-0.30log10 IU/mL、-0.25 log10 IU/mL,各剂量组下降程度无明显差异。

药代动力学分析表明,GST-HG141血药浓度在25~50mg BID范围内呈线性关系趋势,且该范围内的平均谷浓度足以覆盖蛋白结合调整后的EC50
25mg BID、50mg BID和100mg BID连续给药28天,血浆中GST-HG141中位达峰时间为3.0 ~ 3.5小时(第1天)和2.0~ 3.5小时(第28天),第 8 天 达到稳态,GST-HG141在体内有轻微的蓄积。第 28 天,25mg BID、50mg BID和100mg BID 组受试者的GST-HG141平均谷浓度分别比其蛋白结合调整后的 HBV DNA EC50(17ng/ mL)高 4.4、11.1 和 14.6 倍。
广生堂药业高度重视GST-HG141奈瑞可韦的研发工作,截止本稿发布日,广生堂已经完成了从临床前研究到II期临床试验的全部工作,且II期临床试验的研究总结报告显示GST-HG141奈瑞可韦对于慢性乙型肝炎低病毒血症患者具有良好的安全性和显著药效,对HBV DNA的抑制效果显著优于目前临床治疗推荐核苷(酸)类似物单药治疗对照组,在乙肝患者上确证了其在核苷(酸)类药物治疗基础上进一步抑制HBV DNA复制和潜在耗竭cccDNA的作用,临床研究达到预期目标,数据优异。公司将继续秉持科学、严谨的研发态度,加快新药研发进程,为全球乙肝患者提供更多、更好的治疗选择。
参考文献
Wu et al. Safety, pharmacokinetics, and antiviral efffcacy of the novel capsid assembly modulator GST-HG141 in patients with chronic hepatitis B: a phase 1 trial with a randomized,placebo-controlled design.Virology Journal (2024) 21:328 https://doi.org/10.1186/s12985-024-02584-8


